教学用书:原子 1
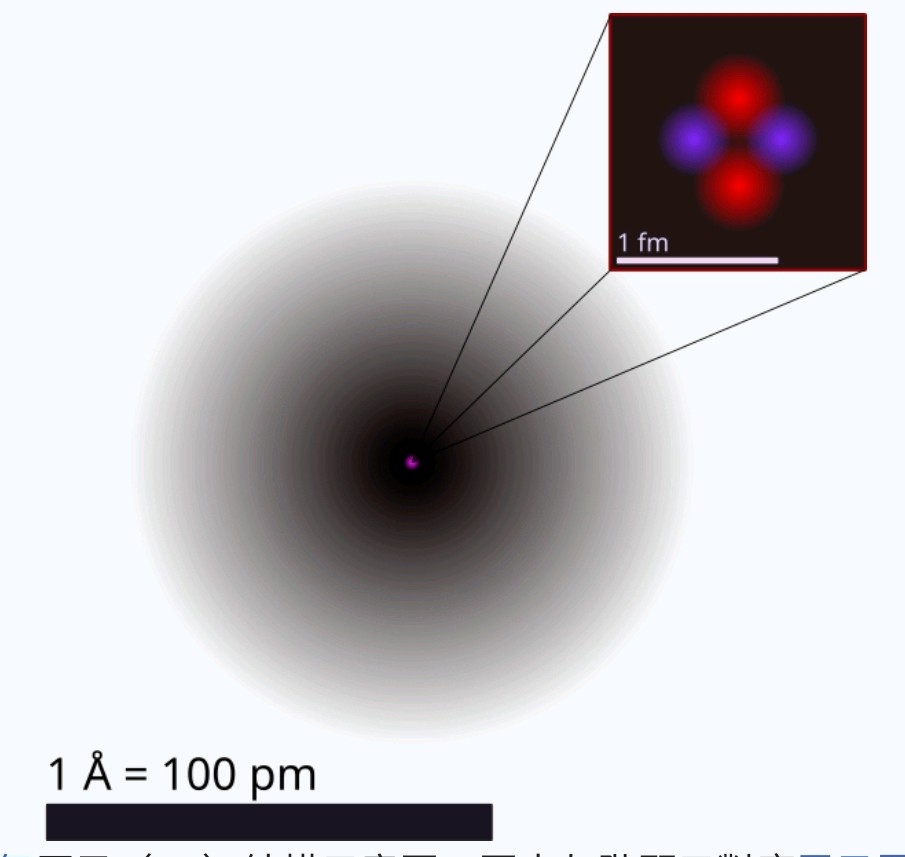
原子,物质的组成部分,一个原子主要由三个次原子粒子组成(在这之中还有更小的细分,鉴于是基础课程,于此不做多解释),分别是中子、质子及电子,而在特定元素上,中子是可以不存在于原子之中。3XzJlX
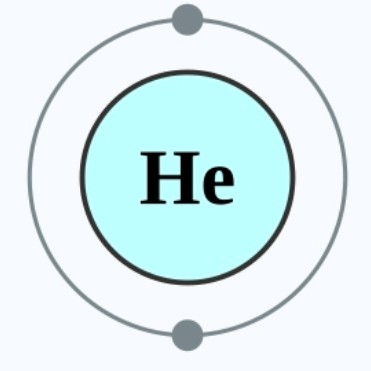
而这三种次原子粒子在原子之中的位置及作用,我将会以氦原子(具有两个中子,两个质子以及两个电子的稳定原子)为例进行讲述。3XzJlX
关于原子內电子的排布有多种说法,但关于中子和质子则公认一种说法,就是中子与质子都会在原子中央,形成一个由中子和质子组成的原子核。3XzJlX
第一种,电子是一团带有负电荷的能量,他们会围绕着带正电荷的原子核(之后细讲正负电荷),以此形成一个球体(见图1.1)3XzJlX
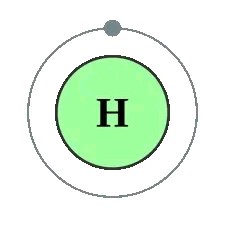
第二种,电子是一个极小的粒子,其会被正电负的原子核吸引,但会与原子核保持一定距离进行十分随机的移动,而其保持的距离可称为电子层(见图1.2),一个电子层可容纳的电子数目有限,当电子层数目超过上限,则会进入下一层电子层,每一层电子层与原子核之间的距离会越来越远。 3XzJlX
电子层最大可容纳电子数目的数量为2n²,其中n为当前电子层层数,如第一层可容纳2个电子,第二层可容纳8个电子,第三层可容纳18个电子以此类推。3XzJlX
三种次原子粒子中,中子和质子的质量近乎一致,唯有电子的质量与两者相差甚远,其中质子帶有正电荷,电子带有负电荷,中子则为电中性。因此,当一个原子核里面拥有质子时,具有负电荷的电子便会被其正电荷吸引。所以原子核虽然是带正电荷,但由于原子内被吸引的电子,会令原子变为电中性。3XzJlX
但是电中性并不代表稳定,我们刚才提到氦原子是一个稳定的原子(排除极端情况),这是因为它的「最外层的电子层」中电子为「电子偶」排布,即第一层电子层(它只有第一层电子层,因此第一层便是最外层电子层)中拥有两个电子。因此,氦原子会较氢原子(只拥有一个电子)更加稳定。3XzJlX
那是不是说所有电子层只要有两个电子,或者说填满的电子层那便是稳定的元素?并不是。3XzJlX
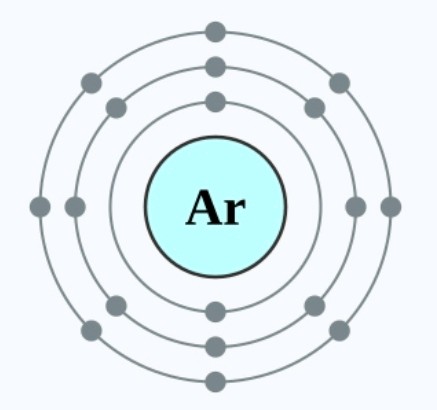
它最外层电子层有两个电子,同时最外层电子层也没有被填满(第三层可容纳18个电子),但是它仍然是稳定的原子,这是因为它的最外层电子层具有第二个稳定的电子排布,可以称之为「八隅体」。3XzJlX
八隅体是指最外层电子层中具有8个电子(或可理解为8个最外层电子),凡是拥有8个最外层电子的原子,其都是稳定的原子,比如氖、氩、氙、氡等等。3XzJlX
所以我们可以统称一个稳定的原子的定义,便是拥有「电子偶」排布,即只有第一层电子层的情况下,拥有2个最外层电子。或是拥有「八隅体」排布,即拥有8个最完成电子。3XzJlX
在了解了什么叫稳定的原子之后,想必各位都有疑惑,所有的原子都是拥有这种排布吗?并不是的,有些原子会多或缺少几粒电子达到八隅体或电子偶排布,那这些原子便是不稳定的原子。3XzJlX
因为原子会趋向稳定,所以说当他们多了一粒电子时,便会想尽办法舍弃那一粒电子;当他们少了一粒电子时,便会想尽办法获得那一粒电子,而这个两种行为的目的皆在于达到稳定的电子排布。3XzJlX
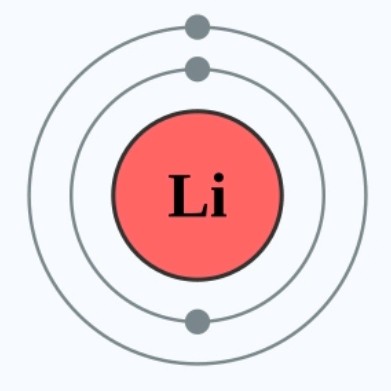
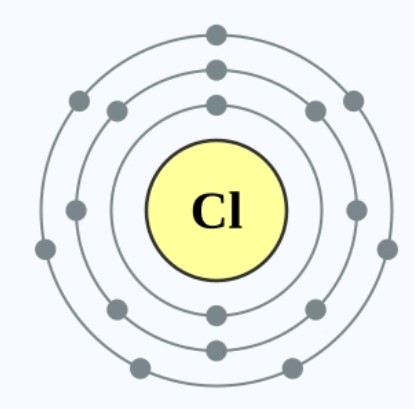
比如锂会失去一粒电子变成电子偶排布,氯会获得一粒电子达到八隅体排布。而元素原子最终达到的稳定排布是取决于元素原子当前拥有的电子层数目。3XzJlX
那么,他们如何获得,又或者如何失去电子呢?那便是和其他元素原子反应。因此这些元素的原子都是不稳定的原子。(除个别活性极低的情况下,如金)3XzJlX
正所谓强强联手,在氯化锂中,氯会夺走锂的电子达到八隅体结构,同时锂也会因为失去一粒电子变成电子偶结构。3XzJlX
那么问题又来了,一边多了一个电子,一边又少了一个电子,他们之间电荷怎么平衡呢?3XzJlX
再次强强联手,带有正电荷的锂「离子」会和带有负电荷的氯「离子」形成静电引力(或理解为正负吸引力),从而形成「键合」。当然,元素之间的键合会在之后提起,在这只是简单做的引述。(离子的描述见之后的篇章)3XzJlX
在理解完为什么元素会反应后,我们又如何判断元素反应的程度呢?3XzJlX
首先,什么叫元素反应的程度?我们可以通称其为「活性」,活性越高的元素越趋向与其他元素反应。同时,活性越低的元素越不会与其他元素反应。比锂的活性高,它会趋向和其他元素反应,失去电子。氖的活性极低,其几乎不会与任何元素反应。3XzJlX
那么,我们如何判断活性的高与低呢?很简单,就是达到八隅体排布的难易程度。3XzJlX
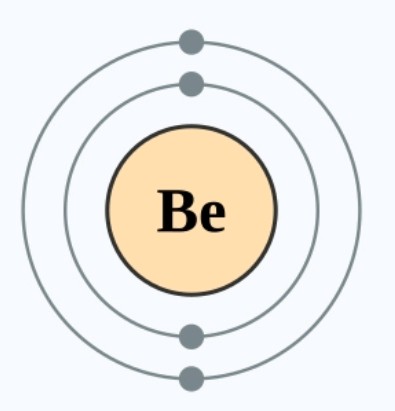
我们先以失去电子的原子为例,锂比铍少一个电子,同时它们拥有相同的电子层。那么,谁会更易失去电子达到电子偶呢?3XzJlX
在失去电子的原子中,拥有同一数目电子层的情况下,最外层的电子越少,其就越容易达到八隅体或电子偶排布,因此,我们可以直接判断锂的活性比铍高。(锂原子见图5)3XzJlX
那么如果有相同电子数目,不同电子层又怎么判断?同样很简单,每一个电子层与原子核之间的距离,会随着层数增加而增加,比如第二层电子层与原子核的距离,会比第一层与原子核的距离较远。3XzJlX
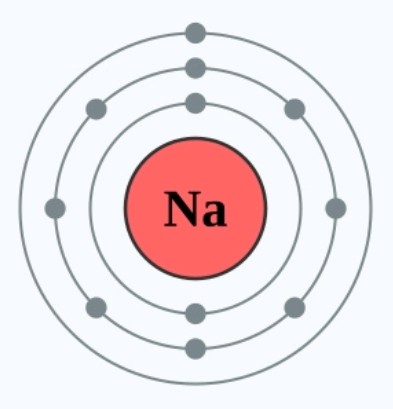
同时,原子核与电子的引力也会因为距离增加而减弱。因此以钠和锂为例,钠会比锂更容易失去最外层电子,因为钠原子核与最外层电子之间的引力会弱于锂,导致钠的活性会比锂高。3XzJlX
因此,以失去电子的原子为例,判断其活系高低便有两种方法。3XzJlX
2.最外层电子数目越少,越容易达到稳定电子排布,活性越高。3XzJlX
失去电子的原子其活性判断已经大致讲清楚了,那么便是获得电子的原子其活性判断了。3XzJlX
它的判断条件和失去电子的原子其实大差不差,只是刚好整个「反」过来。3XzJlX
2.最外层电子数目越少,越难达到稳定电子排布,活性越低。3XzJlX
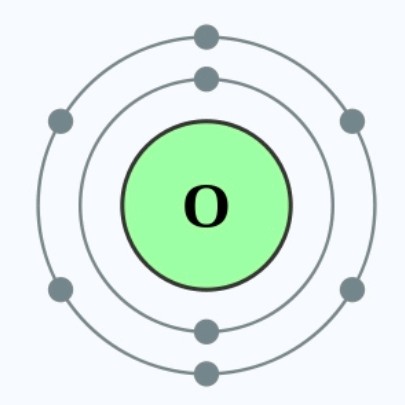
首先,我们以相同电子层的氧及氟为例,氧原子拥有6个最外层电子,它需要获得两个电子去达到八隅体排布。3XzJlX
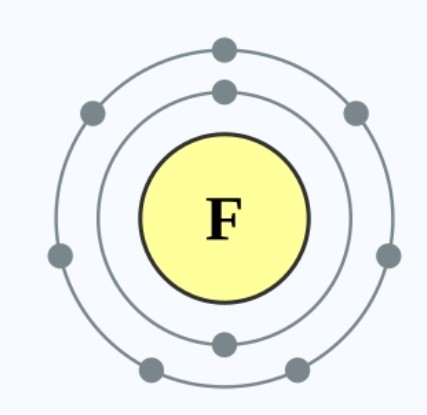
氟原子又有7个最外层电子,它只需要获得一个电子便可达到八隅体排布。3XzJlX
因此,相比氧原子而言,氟原子会更容易达到八隅体结构,其活性便高于氧。3XzJlX
我们在用氟原子和氯原子为例,氯拥有三个电子层,氟气拥有两个最外层电子层。3XzJlX
相比于氯,氟的原子核吸引电子的引力会更强,因为它原子核的正电荷与电子的引力,会较少的因为距离而衰减,令它更容易获得电子,从而活性高于氯。(氯原子见图6,氟原子见图10)3XzJlX
在了解了不同原子之间的活性判断后,那些失去或获得电子的“原子”是不是就少了或多了一个电子,我们应该称呼它们为什么?3XzJlX
上述我们提到的锂离子以及氯离子,它们分别是在它们的元素符号的右上角加一个「+」以及一个「-」,即Li⁺、Cl⁻为什么要这样?3XzJlX
因为锂离子比锂原子少了一粒电子,自然就多了一个质子的正电荷(Li⁺),同理铍离子会比铍原子多两个质子的正电荷。那么,它的元素符号右上角便会写2+(Be²⁺)。3XzJlX
同理,氯离子会是 - (Cl⁻),因为它比氯原子多了一粒电子。氧离子会是2- (O²⁻),因为它会比氧原子多了两粒电子。3XzJlX
这便是「离子」,然而上述的定义只适用于部分主族的元素,过渡元素则不适用上述对于离子的规则,详细内容会在之后再进行讲解。3XzJlX
本次课文简单介绍的原子、离子、元素活性以及什么叫稳定的排布。3XzJlX
(ps.除了这个括号外,记得其他没有加ps.的括号都是尤文的注解,当然各位观众老爷也知道,泰拉貌似没有元素周期表。因此,这个文章里面的许多内容在现实里教的时候会有很多问题,到时候再慢慢的看尤文如何解决。)3XzJlX
3XzJlX2